Obsah
- Počet elektronů ve valenčním plášti
- Krok 1
- Krok 2
- Krok 3
- Krok 4
- Lewisova struktura
- Krok 1
- Krok 2
- Krok 3
- Formální náboj každého atomu
- Krok 1
- Krok 2
- Krok 3
Při určování formálního náboje molekuly, jako je CoCl2 (plynný fosgen), je nutné znát počet elektronů ve valenční vrstvě každého atomu a Lewisovu strukturu molekuly.
Počet elektronů ve valenčním plášti
Krok 1
Hledejte každý atom v periodické tabulce prvků a určete počet elektronů ve valenčním shellu.
Krok 2
Nezapomeňte, že dva elektrony jsou na první podúrovni, dva jsou na druhé podúrovni, šest elektronů na první podúrovni p atd. Pamatujte: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
Krok 3
Udeřte na náklad. Pokud je molekulou ion, přidejte nebo odečtěte jeden nebo více elektronů od celkového množství, abyste dosáhli konečného náboje.
Krok 4
Pro CoCl2 (plynný fosgen): C = 4; O = 6; Cl = 7. Molekula není ionizovaná a má neutrální náboj. Proto je celkový počet elektronů ve valenčním plášti 4 + 6 + (7x2) = 24.
Lewisova struktura
Krok 1
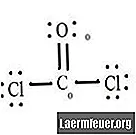
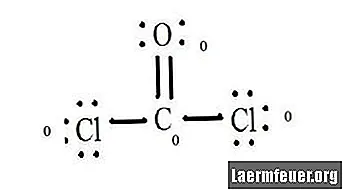
Viz diagram Lewisovy struktury CoCl2 (plynný fosgen). Lewisova struktura představuje nejstabilnější a nejpravděpodobnější strukturu molekuly. Atomy jsou taženy spárovanými valenčními elektrony; mezi volnými elektrony se vytvářejí vazby, které splňují pravidlo oktetu.
Krok 2

Nakreslete každý atom a jeho valenční elektrony a podle potřeby vytvořte vazby.
Krok 3
Atomy chloridu sdílejí jednoduché vazby s molekulou uhlíku, zatímco atom kyslíku tvoří dvojnou vazbu s uhlíkem. Každý atom ve výsledné struktuře splňuje pravidlo oktetu a má osm elektronů ve valenčním plášti, což umožňuje molekulární stabilitu.
Formální náboj každého atomu
Krok 1
Počítejte páry elektronů bez atomů každého atomu ve struktuře Lewis. Každému atomu je přiřazen elektron z každé vazby, na které se podílí. Přidejte tato čísla. V CoCl2: C = 0 volných párů plus 4 elektrony vazeb = 4 elektrony. O = 4 elektrony volných párů plus 2 elektrony vazeb = 6 elektronů. Cl = 6 elektronů volných párů plus jeden elektron vazby s C = 7 elektronů.
Krok 2
Odečtěte množství počtu elektronů ve valenčním plášti nevázaného atomu. Výsledkem je formální náboj pro každý atom. V CoCl2: C = 4 valenční elektrony (ev) v nenavázaném atomu minus 4 elektrony určené ve struktuře Lewis (LS) = 0 formální náboj O = 6 ev - 6 LS = 0 formální náboj Cl = 7 ev - 7 LS = 0 formálního nákladu
Krok 3
Při psaní umístěte tyto náboje blízko atomů do struktury Lewis. Pokud má molekula náboj celkem, umístěte Lewisovu strukturu do závorek s nábojem napsaným na vnější straně v pravém horním rohu.