Obsah
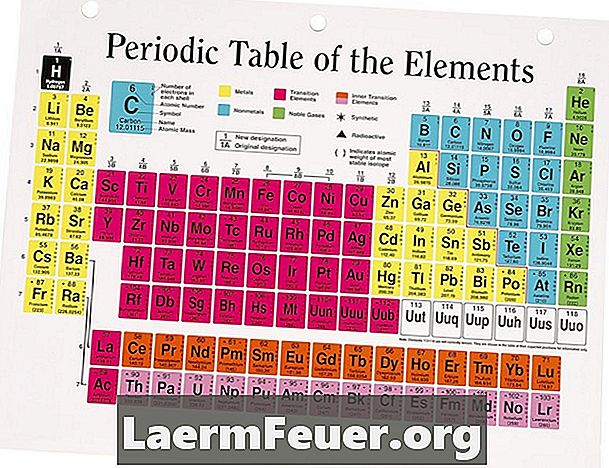
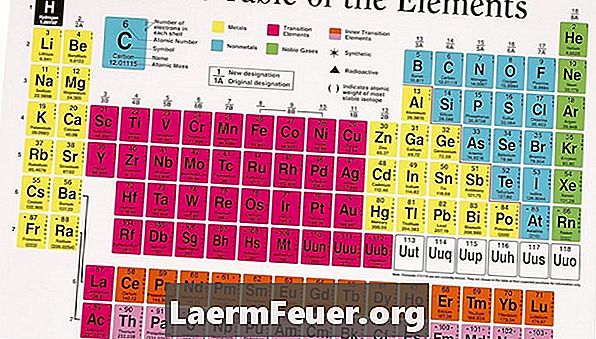
Valenční elektrony jsou elektrony nejvzdálenější vrstvy, kterou může atom vyplnit. Jsou významné, protože se obvykle podílejí na chemických reakcích. Periodická tabulka prvků je praktickým odkazem pro rychlé stanovení počtu valenčních elektronů v atomu. Je však třeba poznamenat, že mnoho prvků, většinou přechodných kovů a dokonce i nekovů, může mít v závislosti na konkrétní sloučenině několik valenčních stavů.
Pokyny
-
Vyhledejte prvek v periodické tabulce. Jsou umístěny v tabulce atomovým číslem zleva doprava, shora dolů. Uspořádání prvků v řádcích odpovídá vlastnostem sdíleným mezi nimi v daném sloupci, významně se řídí podobnostmi v uspořádání těchto elektronů.
-
Identifikujte sloupec, ve kterém je prvek umístěn. Každý sloupec je pojmenován číslem poblíž jeho vrcholu. Systém číslování aktuálně přijímaný IUPAC je postupně číslován od 1 do 8. Dříve, IUPAC pojmenované sloupce 1A, 2A, 3A, a tak dále. Zatímco nové periodické tabulky musí být do nového systému dovybaveny, staré mohou používat předchozí nomenklaturu.
-
Spočítejte počet sloupců zleva doprava, ignorujte přechodové kovy a poslední sloupec vpravo. Napište to jako počet valenčních elektronů. Například, pomocí předchozího systému číslování, jednoduše napsat římskou číslici ve sloupci pojmenovaném jako valenční elektronová čísla, pro prvky ve skupinách IA, IIA, IIIA, IVA, VA, VIA a VIIA.
-
Napište nulu pro počet valenčních elektronů pro prvky skupiny 18 (dříve nazývaná skupina VIIIA). Tyto prvky představují nejvzdálenější elektronovou vrstvu naplněnou a obecně nejsou zapojeny do chemických reakcí.
-
Pro prvky umístěné v přechodovém kovovém bloku periodické tabulky, napište slovo "mění se", protože uspořádání elektronů v těchto prvcích umožňuje účastníkům v nejvnitřnější vrstvě účast na chemických reakcích. Tím se zdají mít valenci, která se mění v různých reakcích. Například železo reaguje někdy pomocí dvou elektronů a další tři, což mu dává zdánlivou valenci dvou nebo tří.
Co potřebujete
- Periodická tabulka prvků